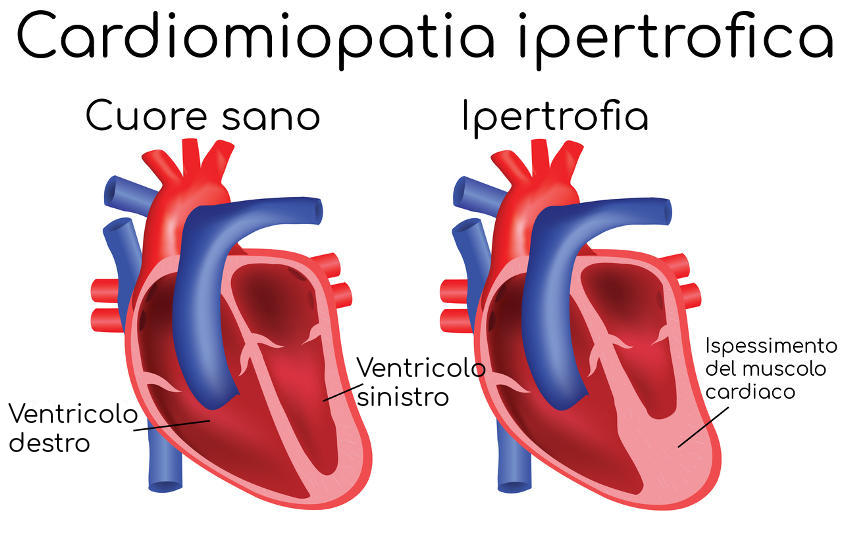
Christian Eriksen sarebbe stato colto da un malore causato da cardiomiopatia ipertrofica. La cardiomiopatia ipertrofica è una condizione in cui il muscolo cardiaco si ispessisce, diventando ipertrofico, in assenza di dilatazione dei ventricoli. La cardiomiopatia ipertrofica colpisce uomini e donne in egual misura. Spesso non viene nemmeno diagnosticata a causa dell’assenza di sintomi e in molti casi permette di condurre una vita normale.
Che cos’è la cardiomiopatia ipertrofica e cosa c’entra con Eriksen
Le possibili manifestazioni sono: aritmie (che possono causare una morte improvvisa), sintomi da ostruzione all’efflusso del sangue dal ventricolo sinistro (come vertigini e svenimenti), da scompenso cardiaco e da ischemia miocardica. Nelle cardiomiopatie ipertrofiche il ventricolo sinistro diviene meno elastico e ha quindi una ridotta capacità di accogliere il sangue proveniente dai polmoni. Il risultato è una riduzione della quantità di sangue pompata dal cuore (insufficienza cardiaca “diastolica” o “con conservata frazione di eiezione”): da qui i sintomi da scompenso cardiaco.
È presente poi una disfunzione microvascolare che determina ischemia miocardica, che può portare a microinfarti; a ciò sono forse in parte attribuibili i dolori al petto spesso presenti in questa patologia. Si parla di cardiomiopatia ipertrofica ostruttiva quando il setto che separa i due ventricoli si ispessisce a tal punto da ostruire l’efflusso del sangue dal ventricolo sinistro; ciò si associa a distorsione dell’apparato valvolare mitralico, che determina incontinenza della valvola. In circa il 3% dei pazienti la cardiomiopatia ipertrofica evolve in una forma dilatativa con scompenso cardiaco refrattario e prognosi infausta.
Quali sono le cause della cardiomiopatia ipertrofica?
In genere alla base della cardiomiopatia ipertrofica c’è una mutazione genetica, che determina non solo l’ipertrofia miocardica, ma anche una disposizione anomala delle fibre muscolari cardiache.
Quali sono i sintomi della cardiomiopatia ipertrofica?
Quando presenti, i sintomi della cardiomiopatia ipertrofica possono essere fiato corto, dolore al petto e svenimenti (soprattutto durante l’esercizio fisico o sforzi), vertigini, affaticamento e palpitazioni.
Come prevenire la cardiomiopatia ipertrofica?
Trattandosi di una malattia ereditaria, non esistono metodi per prevenire la cardiomiopatia ipertrofica. Il rischio che il figlio di un individuo affetto dal problema erediti la mutazione genetica alla sua base è del 50%.
Diagnosi
Il medico può sospettare la presenza di una cardiomiopatia ipertrofica se nel corso di una visita medica rileva un soffio al cuore.
Per confermare la diagnosi possono essere prescritte le seguenti analisi:
- Ecocardiogramma: è un test di immagine che visualizza le strutture del cuore e il funzionamento delle sue parti mobili. L’apparecchio invia un fascio di ultrasuoni al torace, attraverso una sonda appoggiata sulla sua superficie, e rielabora gli ultrasuoni riflessi che tornano alla stessa sonda dopo aver interagito in modo diverso con le varie componenti della struttura cardiaca (miocardio, valvole, cavità). E’ l’esame cardine: permette di valutare l’aumento di spessore delle pareti ventricolari e di individuare l’eventuale ostruzione all’efflusso dal ventricolo sinistro determinata da un’eccesiva ipertrofia del setto interventricolare, nonché l’insufficienza mitralica che si associa all’ostruzione; può mostrare segni di disfunzione diastolica.
- ECG: registra l’attività elettrica del cuore. Può presentare molteplici alterazioni, tra cui, in particolare, segni di ipertrofia ventricolare sinistra.
- ECG dinamico secondo Holter: L’Holter è il monitoraggio prolungato nelle 24 ore dell’ECG. Può documentare aritmie.
- Cateterismo cardiaco: metodica invasiva che si basa sull’introduzione di un piccolo tubo (catetere) in un vaso sanguigno; il catetere viene poi spinto fino al cuore e consente di acquisire informazioni importanti sul flusso e sull’ossigenazione del sangue, e sulla pressione all’interno delle camere cardiache e delle arterie e delle vene polmonari. È effettuato raramente; documenta un aumento delle pressioni di riempimento del ventricolo sinistro, diretta conseguenza della sua ridotta elasticità, e può documentare, nelle forme più avanzate, ipertensione polmonare.
- Risonanza magnetica (RM) cardiaca con mezzo di contrasto: produce immagini dettagliate della struttura del cuore e dei vasi sanguigni attraverso la registrazione di un segnale emesso dalle cellule sottoposte ad un intenso campo magnetico. Permette di valutare accuratamente l’aumento di spessore delle pareti ventricolari e di identificare le cicatrici (aree di “fibrosi”), conseguenza dei microinfarti.
- Indagini genetiche: si effettuano analizzando il DNA dei globuli bianchi contenuti in un campione di sangue ottenuto mediante un normale prelievo venoso. È possibile effettuare la ricerca delle mutazioni genetiche associate allo sviluppo di cardiomiopatia ipertrofica; nel caso venga identificata una mutazione associata allo sviluppo di cardiomiopatia ipertrofica, sarà poi possibile studiare i familiari “sani”: coloro in cui la ricerca della mutazione risulterà negativa potranno essere rassicurati che non svilupperanno la patologia.
Trattamenti
Gli obiettivi del trattamento della cardiomiopatia ipertrofica sono il miglioramento dei sintomi e, nei pazienti ad alto rischio, la prevenzione della morte cardiaca improvvisa.
I possibili approcci terapeutici includono:
- L’assunzione di farmaci che migliorano il “rilassamento” del muscolo cardiaco e rallentano i battiti, come i beta-bloccanti, i calcio-antagonisti e alcuni antiaritmici.
- L’intervento chirurgico per eliminare l’ostruzione all’efflusso del sangue dal ventricolo sinistro derivante dall’ispessimento del setto che separa i due ventricoli.
- L’alcolizzazione del setto interventricolare per eliminare l’ostruzione all’efflusso del sangue dal ventricolo sinistro derivante dall’ispessimento del setto nei casi in cui non sia possibile l’intervento chirurgico; questa procedura prevede l’iniezione di alcool in un ramo delle coronarie che irrora la porzione di setto responsabile dell’ostruzione.
- L’impianto di un defibrillatore automatico (ICD) nei pazienti ad alto rischio di morte cardiaca improvvisa.
- In presenza di sintomi di scompenso cardiaco: diuretici, anti-aldosteronici.
- In caso di scompenso cardiaco refrattario: trapianto cardiaco.